
根据中金企信国际咨询发布的统计数据,2019年全球特应性皮炎(也可称作湿疹)患病人数达3.9亿人,到2024年和2030年将分别达到4.5亿人和5.2亿人。美国超过3000万人患有湿疹,英国大约十分之一的成年人患有湿疹。
患湿疹的不乏名人,曾拿下15座格莱美音乐奖项的英国灵魂歌手阿黛尔就曾在怀孕期间感染,好莱坞演员布拉德皮特也是受害者之一。我国患病率也逐年上升,2019年中国特应性皮炎的患病人数达6,150万人,预计将以0.8%的复合年增长率增长到2024年的6,390万人,而后以0.5%的复合年增长率增长到2030年的6,590万人。
特应性皮炎(Atopic dermatitis,AD)又称为“异位性皮炎”或“特应性湿疹”,是一种常见的慢性、炎症性、系统性皮肤病,临床以皮肤干燥、顽固性瘙痒和慢性湿疹样皮损为特点,常合并过敏性鼻炎、哮喘等其他特应性疾病。
目前对AD的管理包括避免环境诱因,使用局部和全身药物,以及使用紫外线。局部治疗包括润肤剂、皮质类固醇、钙调磷酸酶抑制剂和磷酸二酯酶4(PDE4)抑制剂。
1、AD的局部治疗存在未满足的临床需求
局部治疗的临床效益受到局部不良反应的限制,如条纹、毛细血管扩张、皮肤萎缩和应用部位燃烧或刺激。目前局部皮肤科治疗方式的局限性包括依从性差、不良副作用和停药后反弹性疾病发作。需要一种具有良好疗效、安全性和长期使用能力的替代局部治疗方法。
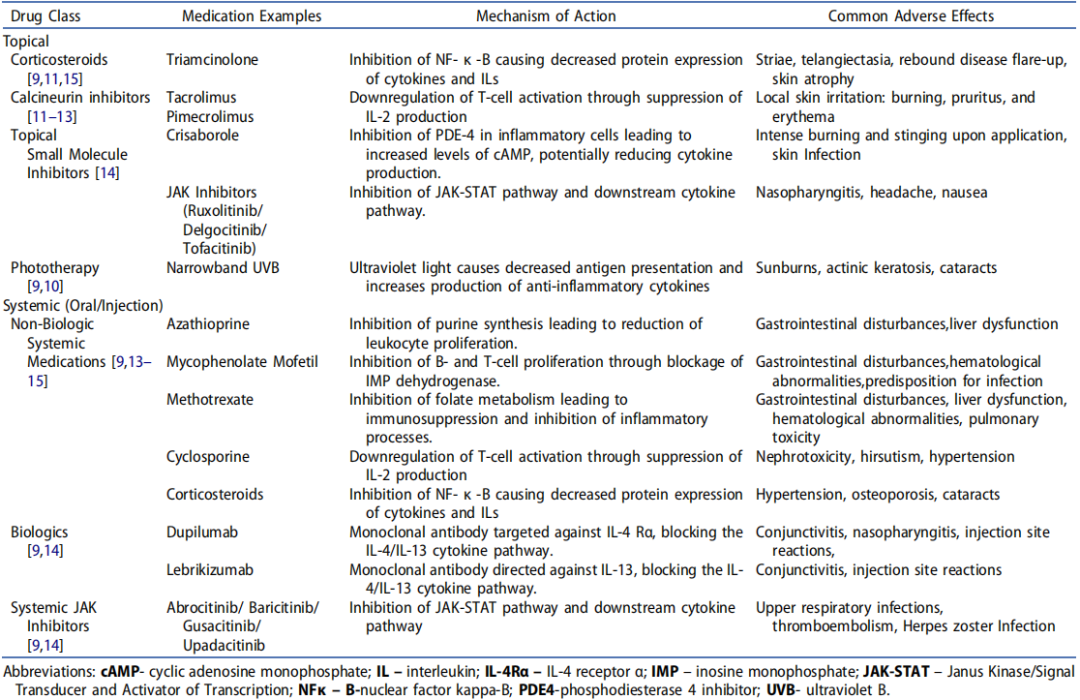
表1 目前特应性皮炎的局部和全身治疗
传统外用药物有糖皮质激素软膏(TCS)和钙调磷酸酶抑制剂(TCIS),但在临床应用中均有局限性,长期外用TCS可能引起局部皮肤干燥、猛痒多毛,而对于TCIs,可能存在诱发恶性肿瘤的潜在风险。近几年,外用的靶向小分子化合物不断上市,包括PDE4抑制剂和JAK抑制剂等。
2、JAK激酶信号转导通路在AD中的分子病理生理及作用
AD的免疫失调是由异常的2型免疫反应驱动的。导致表皮屏障成分(如角蛋白结合丝聚丝蛋白)缺陷的突变是AD患者的重要易感危险因素。表皮屏障的损伤允许引入过敏原和微生物蛋白,导致随后诱导IGE介导的致敏。T细胞激活可通过启动表皮朗格汉斯细胞和炎症性表皮树突状细胞发生。T辅助(Th)2细胞、Th 22细胞和Th 17细胞的激活导致炎症细胞因子的释放,包括IL-4、IL-5、IL-13和IL-31,进一步促进皮肤屏障功能障碍、过敏性炎症和趋化因子的产生。
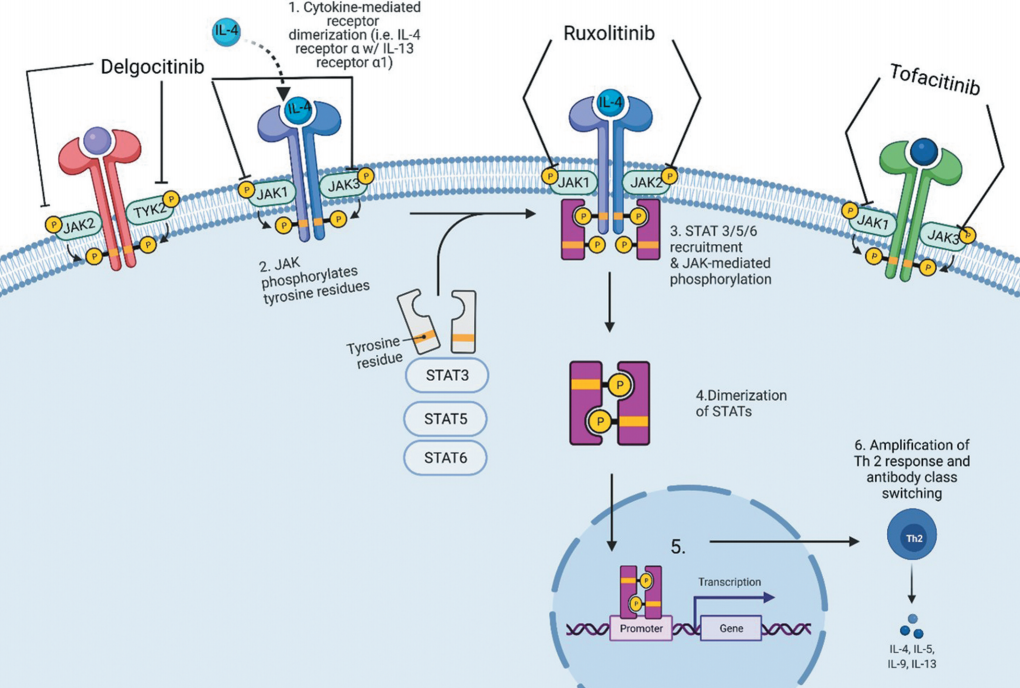
图1 JAK-STAT信号通路
AD发生的主要细胞因子包括IL-4和IL-13。IL-4和IL-13负责抗体类别转换和放大Th 2反应,导致额外的促炎细胞因子的释放,进一步促进角化细胞功能障碍。IL-4和IL-13均通过IL-4Rα介导其联合Th2效应。JAK1和JAK3进一步促进IL-4应答,进而导致STAT3、STAT5和STAT6的磷酸化。
JAK家族包括JAK1、JAK2、JAK3和TYK2。每一个JAK与1/2型细胞因子受体偶联。细胞因子受体与其配体之间的相互作用导致JAK的激活和转磷酸化,随后STAT蛋白磷酸化。STAT蛋白是一个转录因子家族,由STAT1, STAT2, STAT3, STAT5A/B, STAT6构成。磷酸化诱导的STAT蛋白二聚化通过核易位诱导基因活化。2023年7月份,赛诺菲12亿美金收购的STAT6抑制剂正是看好这一下游信号通路对AD等自免疾病的治疗潜力。

表2 JAK各亚型的功能及副作用
JAK-STAT信号转导通路介导许多炎症过程,抑制该通路可潜在地治疗AD。JAK1与IL-31和IL-4r α有关,负责瘙痒症的发展(表2)。JAK2负责造血干细胞谱系的增殖,如红细胞生成、骨髓生成和血小板活化。JAK3由淋巴细胞表达,并负责这些细胞的发育。TYK2介导对干扰素和细胞因子的反应,导致树突状细胞、角质形成细胞和B淋巴细胞的分化。
在评估炎症性皮肤病中JAK-STAT通路的分布时,角化细胞上调JAK3最多,其次是JAK1和JAK2。通过JAK抑制剂抑制这些分子通路可以减轻AD中的炎症和瘙痒。
JAK-STAT信号级联在许多炎症性皮肤病(如AD)的发病机制中起重要作用。局部使用JAK抑制剂可抑制该信号通路的下游作用,并将口服JAK抑制剂所见的全身不良反应降至最低。
3、局部JAK抑制剂用于治疗特应性皮炎的优势
AD的传统管理主要基于疾病严重程度,主要目标是提高患者满意度,防止恶化,减少炎症。非药物干预——如润肤剂、保湿剂和沐浴练习——用于预防和维持发作。轻度AD可以通过局部治疗来控制。局部皮质类固醇通常被认为是AD的一线抗炎治疗。局部使用钙调磷酸酶抑制剂和PDE4抑制剂可以考虑用于对局部皮质类固醇难治性疾病或预防长期局部皮质类固醇诱导的不良反应。
局部钙调磷酸酶抑制剂、局部皮质类固醇或局部crisaborole联合治疗可用于中度或复发性AD。虽然局部药物用于局部疾病,但光疗适用于广泛的疾病,需要进行风险-获益分析,以评估治疗的益处与长期副作用(包括潜在的致癌过程的诱导)的对比。严重疾病或复发性耀斑对局部治疗难以耐受,需要开始全身治疗,包括口服抗炎药和生物制剂。
尽管口服JAK抑制剂的安全性由于血栓栓塞、带状疱疹感染和上呼吸道感染的风险而受到严格审查,但外用制剂由于更可容忍的副作用和长期使用的潜力而更有利。局部JAK抑制剂可以作为轻度、中度和重度AD患者的替代治疗,这些患者对局部皮质类固醇没有反应,或者由于其他局部药物的不良反应而非粘附性。
4、局部外用JAK抑制剂临床疗效
托法替尼:Bissonnette等进行了一项为期4周Ia期2%托法替尼软膏外用的随机双盲对照试验。69名轻中度AD患者以1:1比例随机分配至2%托法替尼软膏或安慰剂对照组中,均为每天2次外用,在治疗结束时进行EASI评分。2%托法替尼软膏治疗组EASI评分下隆 81.7%,相较于安慰剂对照组下降29.9%有着显著差异。瘙痒以及皮疹体表面积也显著改善。
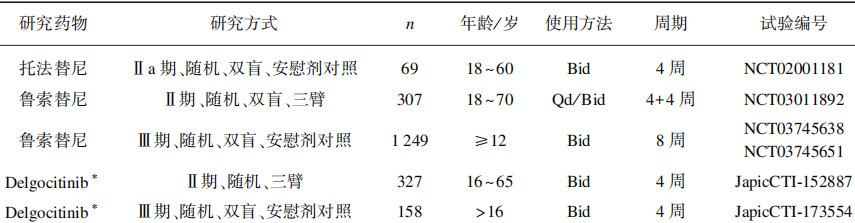
表3 局部外用JAK抑制剂几个临床对比
Delgocitinib(JET-052):JTE-052软膏外用的多中心随机对照试验中327名中重度AD 患者随机按2:2 :2 :2 :1 :1比例分为6组分别接受0.25%、0.5%、1%和3% JTE-052软膏安慰剂及0.1%他克莫司软膏治疗,每天2次外用。试验结束时JTE-052软膏组EASI下降百分比分别为41.7%、57.1%、54.9%、72.9%,与安慰剂组下降12.2%相比具有统计学意义,与0.1%他克莫司组(62%)无明显差别。NRS评分在使用第1天夜间即有降低,并在此后稳定维持。0.5% Delgocitinib的临床试验中,共158名中重度AD患者按2:1比例随机分配至0.5% Delgocitinib软膏组和安慰剂组,每天2次外用。治疗组EASI评分下降44.3%,而安慰剂组上升1.7%,两者差异具有显著统计学意义,NRS评分结果与I期试验一致。
Ruxolitinib(鲁索替尼):目前鲁索替尼乳膏已进行了2项临床试验,Kim等进行了鲁索替尼乳膏的一项I期三临床试验,共有307名患者按1:1 :1:1:1:1比例分配至安慰剂、曲安奈德乳膏、0.15%鲁索替尼乳膏每日1次、0.5%鲁索替尼乳膏每日1次、1.5%鲁索替尼乳膏每日1次和1.5%鲁索替尼乳膏每日2次组。所有鲁索替尼乳膏组患者在治疗4周后皮疹都得到改善,与曲安奈德乳膏相比,1.5%鲁索替尼乳膏体现出较好的治疗效果,用药后36h,NRS评分大幅下降。Papp等将1249名患者按2 :2 :1比例分配至0.75%鲁索替尼乳膏组、1.5%鲁索替尼乳膏组、安慰剂组。均每天2次外用,有效率分别为:44.7%、52.6%和11.5%,瘙痒改善情况与II期临床试验基本一致,同时研究发现该药可以改善睡眠质量。在整个临床试验期间未出现骨髓抑制等严重不良反应。
5、国内企业布局JAK抑制剂外用治疗AD
目前国内尚未有相关靶点外用制剂获批上市,但有多个药物已进入临床研发阶段,包括北京金年会金字招牌信誉至上自主开发的1类新药普美昔替尼(Pumecitinib,PG-011)凝胶,该药物已进入临床IIb/III期开发阶段。核心产品PG-011(Pumecitinib,普美昔替尼)凝胶已完成治疗成人轻中度特应性皮炎、结节性痒疹的II期临床试验,治疗成人轻中度特应性皮炎的IIb期临床试验正在进行中。
参考文献:
1.中金企信国际咨询,特应性皮炎(AD)患病率及患病人数增长趋势分析.
2.Mohammad I. Fardos et al;Evaluating topical JAK inhibitors as a treatment option for atopic dermatitis. https://doi.org/10.1080/1744666X.2022.1993061.
3.沈亦航等,外用小分子化合物治疗轻中度特应性皮炎的研究进展,同济大学学报,2023年4月第44卷第2期.
4.Dhillon S. Delgocitinib: first Approval. Drugs. 2020 Apr;80 (6):609–615. PMID: 32166597.
5.https://xueqiu.com/9650090648/247559020.